嵌合抗原受体(CAR)-T细胞疗法是针对特定血液系统恶性肿瘤的有效治疗策略。然而,这种新疗法在实体瘤治疗方面的结果受到免疫抑制肿瘤微环境(TME)的限制,其中检查点程序性死亡-1(PD-1)/PD-L1的信号传导直接抑制T细胞反应。尽管检查点靶向免疫疗法成功地增加了控制肿瘤生长的T细胞数量,但TME中髓源性抑制细胞(MDSC)和肿瘤相关巨噬细胞(TAM)的作用减轻了预期治疗效果。已有研究证实,靶向TAMs和MDSCs上髓系细胞2表达的触发受体(TREM2)可增强抗PD-1免疫治疗的效果。
2023年8月10日,中山大学黄曦团队在Molecular Cancer(IF=37)上发表题为“Target delivery of a PD-1-TREM2 scFv by CAR-T cells enhances anti-tumor efficacy in colorectal cancer”的研究论文,该研究发现靶向PD-1-TREM2的scFv抑制了PD-1/PD-L1途径的激活。此外,scFvs阻断了配体与MDSC和TAM上TREM2受体的结合,降低了MDSC和TAM的比例,并增强了T细胞效应功能,从而减轻了TME中的免疫抵抗。在皮下CRC小鼠模型中,与PD-1 scFv自分泌CAR-T疗法相比,PD-1-TREM2 scFv自分泌CAR-T细胞可高效消除肿瘤。此外,CAR-T细胞分泌的PD-1-TREM2 scFv仍位于肿瘤内,且半衰期明显延长。
总之,该研究发现在结直肠癌治疗方面,PD-1-TREM2 scFv自分泌CAR-T细胞疗法具有强大潜力。

结肠直肠癌(CRC)是全球癌症相关死亡的第二大常见原因,仅在2020年就报道了190万CRC病例和57.6万例CRC相关死亡。随着全球人口年龄的增长,CRC和相关死亡的发生率持续增加。除了DNA错配修复和遗传超突变性外,导致癌基因积累的遗传改变(如APC、KRAS和PIK3CA)被认为是CRC肿瘤发生的主要驱动因素。手术切除、化疗和放疗是目前用于CRC治疗的主要临床方式。但CRC患者的预后较差,5年总生存率低于15%。因此,迫切需要具有更高效的治疗方案来延长CRC患者的预期寿命,并改善CRC患者生活质量。
近年来,利用人体免疫系统对抗肿瘤的新型免疫疗法得到了越来越多的临床应用。嵌合抗原受体(CAR)-T细胞疗法是最有效的免疫治疗方法之一,尤其在治疗血液系统恶性肿瘤方面。FDA已批准抗CD19 CAR-T细胞疗法用于难治性B细胞急性淋巴细胞白血病患者的临床治疗。然而,CAR-T细胞在缓解实体瘤方面的临床潜力尚未得到充分发掘。一项I期临床研究(NCT02349724)采用癌胚抗原(CEA)-CAR-T疗法,通过静脉输注全身给药治疗CRC患者,但缺乏持续的治疗效果。
除遗传和表观遗传操作外,CRC的发生和发展还受到肿瘤微环境(TME)的显著影响,TME包括免疫检查点,如程序性死亡1(PD-1)/程序性死亡配体1(PD-L1)、LAG-3、CTLA4和TIM3,其浸润免疫抑制性骨髓细胞和调节性T细胞,从而减弱内源性抗肿瘤免疫和CAR-T疗法的治疗效果。CAR-T细胞和免疫检查点阻断(抗PD-1)的联合免疫疗法可增强对实体瘤和血液系统恶性肿瘤的抗肿瘤作用,但靶向PD-1通路仅在微卫星不稳定性高的CRC患者中引起强烈的临床反应,且检查点阻断疗法仅对不到5%的患者有效,表明TME也参与介导癌症免疫治疗耐药性。因此,最近的几项研究侧重于鉴定靶向TME的新分子,以及增强CAR-T免疫治疗效果的联合策略。
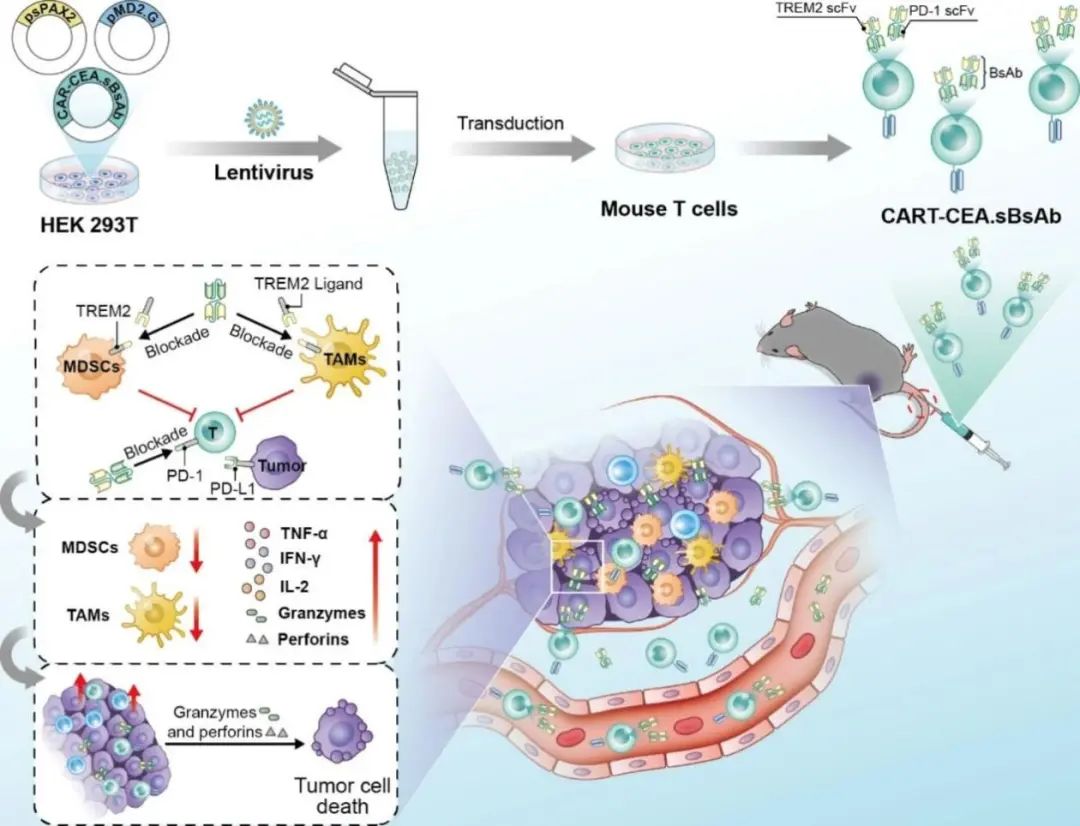
CAR-T细胞靶向递送PD1-TREM2 scFv增强结直肠癌治疗效果示意图(摘自Molecular Cancer )
免疫球蛋白超家族成员骨髓细胞2上表达的触发受体(TREM2)结合脂质,通过12kDa的衔接体DNAX激活蛋白(DAP12)传递细胞内信号,并在诱导阿尔茨海默病(AD)发病中起关键作用,TREM2激活小胶质细胞吞噬并选择性破坏AD特有的毒性蛋白聚集物。在TME中,TREM2在骨髓免疫抑制中起重要作用。TREM2主要在肿瘤相关巨噬细胞(TAM)表面表达,是TAM和单核细胞的基本表型标志物,具有强大的免疫抑制活性。在TAMs上靶向TREM2可提高卵巢癌的免疫治疗效果。因此,TREM2是针对TME的有效治疗靶点。TREM2的缺失增强了CRC动物模型中抗PD-1介导的免疫疗法,有研究表明与野生型小鼠相比,Trem2–/–小鼠中MC38肿瘤的生长受到显著抑制。因此,TREM2和PD-1的抗体组合具有增强CAR-T细胞疗法肿瘤治疗效果的潜力。
全长抗体在肿瘤治疗药物开发中的应用受其高分子量、组织中低通透性以及与可结晶片段(Fc)片段相关毒性的限制。该研究旨在开发一种单一的CRC疗法,使用CAR-T细胞递送源自抗TREM2和抗PD-1抗体的PD-1-TREM2单链可变片段(scFv),实现肿瘤部位的特异性定位。此外,该研究通过延长PD-1-TREM2单链抗体的半衰期,增强其临床适用性。作者发现因PD-1-TREM2 scFv的低分子量特性,其肿瘤组织穿透明显改善,尽管该scFv在体内的半衰期比全长抗体短。CAR-T细胞持续分泌的PD-1-TREM2单链抗体可以靶向TME,从而重塑其免疫抑制,提高CAR-T治疗结直肠癌的疗效。
